COVID-19 – vaktsiiniarenduse katalüsaator
Vaktsiinid on COVID-19 ohjamise peamine meede – eeldusel, et need jõuavad inimesteni ja inimesed usaldavad neid.
Kui esimene COVID-19 vaktsiin sai 11. detsembril 2020 Ameerika Ühendriikide Toidu- ja ravimiametilt erandkorras kasutamise loa ja 21. detsembril Euroopa Komisjonilt tingimustega müügiloa, siis oli see üllatuseks nii vaktsiiniarendajatele ja ravimijärelevalvajatele kui ka arstidele ja avalikkusele. Sellele eelnenud üleilmne koordineeritud pingutus COVID-19 vaktsiinide arendamisel ja nakkushaiguste valdkonna soikunud rakendusteaduse kiire ärkamine näitas, et kõigi asjaosaliste sihikindel tegutsemine ja hea tahe ning ammuteada takistuste kõrvaldamine toovad loodetud tulemuse.
COVID-19 VAKTSIINID TOETUVAD VARASEMATELE KOGEMUSTELE JA TEADUSTULEMUSTELE
Kuigi 20 aastat pandeemiasimulatsioone ei olnud piisavad, et maailm olnuks Wuhanist alguse saanud SARS-CoV-2 viirusega toimetulekuks valmis, ei alanud COVID-19 vaktsiinide arendus ei sisulises ega logistilises mõttes tühjalt kohalt (Maxmen, Tollefson 2020) ning ettekujutus, et vaktsiinid loodi vähem kui aastaga, ei ole päris täpne.
Võrreldes teiste pandeemia edukaks tõrjumiseks vajalike meetmetega, nagu tervishoiusüsteemi üldine tugevdamine või keeruka modelleerimise oskusega teadlaste meeskondade loomine, oli vaktsiiniarendus heas stardipositsioonis. Üle 200aastane kogemus vaktsiinide kasutamisel nakkushaiguste leviku tõkestamisel tagas neile piisava tähelepanu kohe pandeemia algfaasis ning hiljutiste simulatsiooniõppuste järel loodud rahvusvahelised kiirenduskonsortsiumid (nt Coalition for Epidemic Preparedness Innovations, CEPI) leidsid kohe rakendust.
Koroonaviiruste põhjustatud tõsised nakkused ei olnud viroloogidele ja vaktsiiniteadlastele uudiseks. Kuigi 1960. aastatel iseloomuliku kuju järgi nime saanud viirusi peeti aastaid inimestele suhteliselt ohutuks, olid 2002. aastal Hiinast Guangdongist alanud ebatüüpilise kopsupõletiku puhang (SARS, severe acute respiratory syndrome, tekitajaks SARS–CoV viirus) ja 2012. aastal esmakordselt Saudi Araabias Jeddahis diagnoositud sarnane tõbi (MERS, Middle East respiratory syndrome, tekitajaks MERS–CoV viirus) teadlastele selgeks ohumärgiks. SARS esines 29 riigis 5 mandril, kokku leiti 8098 nakatunut ja neist 774 surid, MERS levis 26 riigis, kokku diagnoositi 1621 juhtu ning 584 patsienti surid (Bell 2003; Aleanizy 2017). Mõlemal juhul alustati mitmel erineval tehnoloogial baseeruvate vaktsiinide väljatöötamist, viiruse ogavalk oli olulise sihtmärgina identifitseeritud. SARSi inaktiveeritud viirusel põhinev ja DNA vaktsiin ning MERSi viirusvektoriga (sh hiljem COVID-19 vaktsiinis kasutatud ChAdOx1 vektoriga) ja DNA vaktsiin jõudsid ka esimeste inimuuringuteni, ent kuna haiguspuhangud olid selleks ajaks lõppenud, ei jätkunud jõudu rohkemaks.
Vaktsiiniarenduses mõni aasta enne COVID-19 pandeemia algust välja töötatud meetod võimaldas uue viiruse vastase vaktsiini luua kiiresti ja ohutult.
COVID-19 vaktsiinide loomiseks oli erakordselt soodne ka mRNA-l põhineva vaktsiinitehnoloogia äsjane jõudmine inimuuringuteni, esmalt küll teiste nakkushaiguste ja vähktõve valdkonnas. Mõte antigeeni kodeeriva mRNA viimisest inimese organismi, et rakud selle alusel ise vajaliku antigeeni sünteesiks ja seeläbi immuunvastuse esile kutsuks, pärineb enam kui 30 aasta tagant, ent selle edukat rakendamist takistasid mitmed faktorid, ennekõike organismi immuunvastus modifitseerimata mRNA suhtes ja suutmatus vaktsiini mRNA-d degradatsiooni eest kaitsta. Mõni aasta enne COVID-19 pandeemia algust olid need takistused edukalt ületatud ning loodud senisest vaktsiiniarendusest kvalitatiivselt erinev protsess, mis võimaldas uue haigustekitaja vastase vaktsiini kiiresti ja ohutult kokku panna ilma selleks laboris patogeenseid organisme kasvatamata ja rakukultuure kasutamata (Zhang et al. 2019; Pardi et al. 2018). Kui varem oli kõige kiirem vaktsiiniarendus kestnud neli aastat (1960. aastatel loodud mumpsivaktsiin) ja reeglina kulus selleks üle 10–15 aasta, siis Moderna Zika vaktsiin sai kliinilisteks uuringuteks valmis 10 kuuga. COVID-19 uuringuküpse vaktsiini loomiseks kulus ettevõttel alates viiruse genoomi avaldamisest 2020. aasta jaanuaris 42 päeva.
UUTE VAKTSIINIDE KIIRE KASUTUSELEVÕTT
Lisaks kirjeldatud alusteaduslikele teadmistele ja tehnoloogilistele lahendustele on ravimi- ja vaktsiiniarenduses vaja teha kokkulepitud mahus rakendusteaduslikke labori- ja inimuuringuid, et selgitada välja uue toote tõhusus ja ohutus. See on enamasti vaktsiini kasutusele võtmise kõige ajamahukam osa. Nende uuringute nõuded on kokku lepitud ja tavaliselt on uuringute protsess tsükliline: kaks kuni neli aastat labori- ja loomkatseid, seejärel väikesed, mõnekümne osalejaga esimese faasi inimuuringud ohutuse hindamiseks, siis teise faasi uuringud pisut enamatel inimestel immuunvastuse kirjeldamiseks ning seejärel kolmanda faasi uuringud, mis kirjeldavad vaktsiini võimet nakkust või haigust ära hoida ja hindavad kõrvaltoimete sagedust. Kokku võib inimuuringuteks kuluda vähemalt kuus-seitse aastat, sellele järgneb umbes aasta kestev andmete riiklik hindamine ja lõpuks vaktsiini kasutusele lubamine. Paralleelselt rakendusteaduslike uuringutega hindab arendaja igas etapis tulemusi ja riski ärilisest vaatest. Kui vaktsiin saab kasutamiseks loa, alustatakse selle tootmismahu eskaleerimist nõudlusele vastavaks.
COVID-19 vaktsiinide puhul võtsid valitsused ning mitmesugused organisatsioonid arendajate finantsriski enda kanda ning seetõttu viidi küll kõik tavaliselt nõutavad uuringud läbi, ent paljusid neist sai teha paralleelselt, eelmise etapi lõplikke tulemusi teadmata. Ühendriikide programm „Warp Speed“ üksi panustas vaktsiinide arendamisse ja tootmisse üle 10 miljardi dollari, partneriteks Pfizer-BioNTech, Johnson & Johnson, Moderna, AstraZeneca-Oxford, Novavax ja Sanodi-GlaxoSmithKline. Ennetav rahastamine võimaldas luua suure tootmisvõimsuse enne kliiniliste uuringute programmi edu kinnitamist ning vaktsiine sai ette valmis toota.
Paradoksaalsel kombel aitas ka SARS-CoV-2 viiruse laialdane levik vaktsiinide kiirele uurimisele kaasa. Kui vaktsiinide kõrvaltoimeid ja immunogeensust saab hinnata ka ilma olulise nakkusriskita olukorras, siis kolmanda faasi kliinilisi uuringuid tõhususe hindamiseks saab teha vaid siis, kui nakatumise ja haigestumise tõenäosus on olemas – mida suurem, seda parem uuringuteks. Et vaktsineeritud ja vaktsineerimata rühma näitajaid usaldusväärselt võrrelda, on vaja piisavat hulka nakatunuid ja haigestunuid. COVID-19 vaktsiinide paljude kolmanda faasi inimuuringute tegelik kestus osutus planeeritust lühemaks, kuna neid kavandades eeldati madalamat nakatumisriski ja haiguse väiksemat sagedust.
Ka riikliku ravimijärelevalve asutused korraldasid oma töö ümber. Kasutusele võeti A(H1N1)2009 gripipandeemia ja 2014–2016 Ebola epideemia mõjul loodud struktuur ja töökorraldus (Simpson et al. 2020), kus vaktsiinide ja ravimite arendajatele anti selged juhised järelevalvajate ootuste kohta, pakuti tasuta kiiret teaduslikku nõu nii kvaliteedi kui ka vaktsiinide omaduste uurimise kohta ning käivitati paljutõotavate vaktsiinide ja ravimite pidevhindamine (rolling review). Kui esmased andmed viitasid toote potentsiaalile COVID-19 puhul, hakati uuringute tulemusi hindama kohe, kui need valmis said. See võimaldas kasutusele lubamise otsuse teha kahe kuni nelja nädala jooksul pärast kolmanda faasi kliiniliste uuringute valmimist ja müügiloataotluse esitamist, tavapärase kuni 12 kuu asemel. Ka rahvusvaheline koostöö ravimiametite vahel oli tavapärasest tihedam, et vältida nõuete erinevusest tingitud ressursi- ja ajakulu arendajatele ning kiirendada uuringutulemuste hindamist.
Kokkuvõttes, COVID-19 vaktsiinid said ennenägematu kiirusega valmis tänu varasemale teadusandmestikule koroonaviiruste kohta, uuele vaktsiinitehnoloogiale, finantseerimisele, mis võimaldas rakendusuuringuid teha paralleelselt, ning järelevalveasutuste tavapärasest erinevale töökorraldusele tulemuste hindamisel. Osa pandeemia ohjamiseks tehtud muutustest vaktsiinide arendamisel võivad jääda püsima ja hõlbustada ka teiste haiguste vaktsiinide ja ravimite loomist tulevikus, ent paljud asjatundjad rõhutavad ettevõtete finantsriski maandamise tähtsust, mis ei ole väiksema üleilmse majandusliku mõjuga tõbede puhul tõenäoline. Ka ravimijärelevalve süsteemil puudub ressurss pandeemia tingimustes tehtuga sarnaseks pidevhindamiseks ja tagasisideks kõigi paljutõotavate ravimite ning vaktsiinide puhul.
PRAEGUSED COVID-19 VAKTSIINID
Maailma Terviseorganisatsiooni COVID-19 vaktsiinide arendust kirjeldav lehekülg näitas 16. aprillil 2021, et inimuuringutes on 88 ning inimuuringute eelses arendusjärgus 184 COVID-19 vaktsiini kandidaati. Kolmandik inimuuringutesse jõudnud vaktsiinidest sisaldavad viiruse valgulist alaühikut (komponentvaktsiinid), 15 protsenti on mittepaljuneva viirusvektoriga vaktsiinid, 14 protsenti sisaldavad inaktiveeritud viirust ning veel 14 protsenti põhinevad mRNA tehnoloogial.
Euroopa Liidus on kasutusele lubatud kaks mRNA tehnoloogiaga vaktsiini (Pfizeri/BioNTechi Comirnaty ja Moderna COVID-19 vaktsiin) ning kaks adenoviirusvektoriga vaktsiini (AstraZeneca Vaxzevria ja Jansseni COVID-19 vaktsiin) (European Medicines Agency 2021). Euroopa Liidus on COVID-19 vaktsiinid saanud tingimustega müügiloa, mis ei sõltu pandeemia tõkestamiseks kehtestatud muudest meetmetest. Ühendriikides on vaktsiinidele antud erandkorras kasutamise luba, mis kehtib vaid meditsiinilise hädaolukorra tingimustes. Sellest johtuvalt on neljast vaktsiinist kolm tulnud Euroopas kasutusele mõni nädal pärast Ühendriike. AstraZeneca vaktsiinil ei ole artikli kirjutamise ajal USAs veel kasutamise luba.
Kõikide COVID-19 vaktsiinide kasutusele lubamise aluseks on olnud 24 kuni 44 tuhande osalejaga kolmanda faasi kliinilised uuringud. Kuna erinevalt hästituntud nakkushaiguste uutest vaktsiinidest puudus COVID-19 puhul teadmine, millised immunoloogilised parameetrid (nt antikehade tiiter) ennustavad ette vaktsiini võimet nakkuse või haigestumise eest kaitsta, nõuti uuringuid, mis mõõdaks otse vaktsiini mõju nakatumise või haigestumise tõenäosusele, soovitavalt ka raske haigestumise ja haiglaravi vajaduse sagedusele. Vaktsiinide ohutuse hindamiseks on (teiste haiguste seniste vaktsiinide puhul) nõutud vähemalt paari tuhande osalejaga uuringuid ning kuna vaktsiinide kõrvaltoimed avalduvad reeglina nelja kuni kuue nädala jooksul, siis eeldati tingimustega müügiloa andmiseks vähemalt kuuenädalase ohutusjälgimise andmestiku olemasolu.
COVID-19 vaktsiinide kasutuselevõtule eelnenud inimuuringud olid suurimad, mis uute vaktsiinidega seni tehtud.
COVID-19 vaktsiinide kliinilised uuringud olid üldjuhul lihtsad juhuslikustatud uuringud, kus osalejad jagati juhuvaliku alusel vaktsiini või platseebo/võrdlusvaktsiini rühmadesse ning esmase efektiivsusnäitajana loeti kokku laboratoorselt kinnitatud ning sümptomeid tekitanud COVID-19 juhud. Lisaks hinnati COVID-19 raskete juhtude ja haiglaravi sagedust. Uuringute kiire valmimise huvides ei hinnatud põhjalikult asümptoomse nakkuse esinemist, mis oleks eeldanud kõigi osalejate regulaarset laboratoorset testimist, mis käimasoleva pandeemia tingimustes ei oleks pruukinud edukas ega ohutu olla.
Kuna iga vaktsiini toimet ja kõrvaltoimeid hinnati erinevas uuringus, st eri ajal ja eri kohas, siis ei ole uuringute numbrilised tulemused otse võrreldavad. Üldistatult hoidsid adenoviirusvaktsiinid ära 70 protsenti sümptomaatilistest COVID-19 juhtudest ning mRNA vaktsiinid vähendasid nende sagedust üle 90 protsendi. COVID-19 raske kulu eest kaitsesid mõlemat tüüpi vaktsiinid väga efektiivselt ning võrdselt hästi.
Uuringutes osalenute hulgas oli palju inimesi, kel esines vähemalt üks kaasuv krooniline haigus, mis suurendas COVID-19 raske kulu riski. Enamik uuringuid viidi läbi täiskasvanutel, vaid Pfizeri/BioNTechi Comirnaty uuringus osalesid ka 16–18aastased. AstraZeneca Vaxzevria uuringutesse värvati esmalt alla 55aastaseid inimesi ning kuigi uuringute hilisemas faasis kaasati ka eakaid, oli nende uuringus jälgimise aeg nii lühike, et võimaldas küll kokku lugeda kõrvaltoimed, aga COVID-19 juhtude arv oli liiga väike, et vaktsiini tõhusust eakatel usaldusväärselt hinnata. Seetõttu kasutasid mõned riigid seda vaktsiini esialgu alla 65aastastel, kuni teistes riikides kasutamise andmed kinnitasid efektiivsust vanemaealistel.
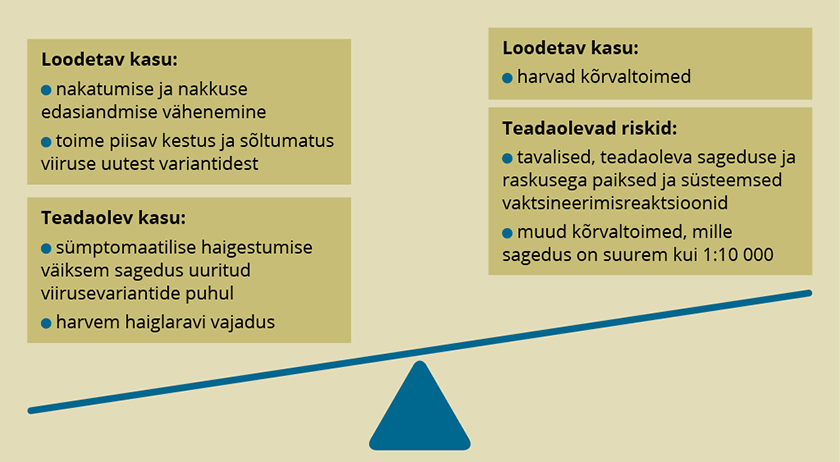
COVID-19 vaktsiinide inimuuringud, mis tehti enne nende kasutusele võtmist, olid suurimad, mis uute vaktsiinidega on enne kasutusele lubamist tehtud. Vaid rotaviiruse vastase vaktsiini uuringud on samas suurusjärgus. See on kohane, sest vaktsineeritute võimalik hulk pärast kasutusele lubamist on väga suur. 20–40 tuhande osalejaga uuringud annavad hea ülevaate tavalistest kõrvaltoimetest ning harvematest kõrvaltoimetest, mille esinemine on sagedasem kui üks 10 000 vaktsineeritu kohta. Üliharvade kõrvaltoimete väljaselgitamiseks on kõigil uutel ravimitel riskijuhtimiskavad, mis näevad kasutamise käigus ette ohutusteabe pideva kogumise. Vaktsiinide kasutusele lubamise kaalumisel arvessse võetud andmete ülevaade on esitatud joonisel 1.
Joonis 1. Uue COVID-19 vaktsiini kasu ja riskide hindamine kasutusele lubamise ajal
Allikas: autori koostatud
Kõik senised COVID-19 vaktsiinid põhjustavad üsna sageli paikseid ja süsteemseid vaktsineerimisreaktsioone. mRNA vaktsiinide puhul on reaktsioonid sagedasemad pärast teist vaktsiinidoosi, AstraZeneca Vaxzevriaga esimese süsti järel. Eakatel on kõik COVID-19 vaktsiinid paremini talutavad kui noortel. Paiksed reaktsioonid esinevad kergel kujul peaaegu kõigil vaktsineeritutel, tavalised on süstekoha hellus või valu, punetus ja turse. Süsteemsed reaktsioonid on nt väsimus, lihas- ja peavalu, iiveldus, külmavärinad ja palavik. Uuringutes ei olnud meil kasutatavate vaktsiinide vahel reaktsioonide sageduses erinevusi: süstekoha valu esines pea kolmveerandil ning kerge või mõõdukas väsimus ja peavalu rohkem kui pooltel vaktsineeritutel. Palavik üle 38 kraadi oli harv, 8 protsendil vaktsineeritutest AstraZeneca Vaxzevria puhul ning 16 protsendil Pfizeri/BioNTechi Comirnaty teise doosi järel.
Esimese üliharva kõrvaltoimena registreeriti vaktsiinide kasutuselevõtmise järel raske allergilise reaktsiooni – anafülaksia – esinemine. Selle hingamis- ja vereringehäirega kulgeva ja reeglina vahetult vaktsineerimise järel tekkiva tõsise reaktsiooni võimalus on vaktsineerimiste puhul teada ning kõik vaktsineerijad on selle ravimiseks valmis.
Teise kõrvaltoimena, mida ei kirjeldatud kliinilistes uuringutes, on algselt AstraZeneca Vaxzevria, hiljem ka Jansseni COVID-19 vaktsiini puhul kirjeldatud nn VIPIT sündroomi (vaktsiinist indutseeritud protrombootiline immuuntrombotsütopeenia). See on aju või kõhuõõneorganite veenides, harva ka arterites tekkiv tromboos, mille põhjuseks peetakse vereliistakute immuunmehhanismiga aktivatsiooni (Cines, Bussel 2021). Ühtegi riskitegurit, mille alusel selle teket ette näha, praegu teada ei ole. VIPIT sündroomi on kirjeldatud peamiselt alla 60aastastel naistel ja see ei ole seotud muude tromboosiga kulgevate haiguste ega nende riskifaktoritega. Praeguste hinnangute kohaselt on VIPIT sündroomi sagedus ka alla 60aastastel väga väike, ligikaudu üks 100 000 kohta. Samasugune risk on surra tromboosi tõttu nt suukaudsete rasestumisvastaste vahendite kasutamisel.
COVID-19 vaktsiinide kasutusele lubamise eelsed uuringud ei andnud teavet vaktsiinide toimest lastel, ei kirjeldanud nende tõhusust immuunpuudulikkuse korral ega ohutust rasedatel. Ka vaktsiini tekitatava kaitse kestus ei ole seni teada. Uuringud lastel ning rasedatel on alanud ning vaktsiini kaitse kestus selgub algsetes uuringutes vaktsineeritute pikaajalisel jälgimisel.
Edasised uuringud peavad selgitama ka vaktsiinide tõhususe SARS-CoV-2 uute variantide suhtes, mida on kirjeldatud mitmeid (Rubin 2021; Moore, Offit 2021). Vajadusel kohandatakse vaktsiine, et tagada kaitse uute viirusevariantide suhtes. Selliste modifitseeritud antigeeniga vaktsiinide puhul, mille kõik muud koostisosad ja toomisprotsess jäävad samaks, ei ole uued platseebovõrdlusega uuringud eetilised ega vajalikud ning nende toimet kirjeldatakse inimuuringuis, mis mõõdavad vaktsiini immunogeensust.
VAKTSIINIDE MÕJU
COVID-19 vaktsiinide suhtes on suured ootused, mille täitumine ei sõltu ainult edasisest edukast vaktsiiniarendusest ja piisavast tootmisest. Vaktsiinid saavad loodetud mõju avaldada siis, kui nad vähendavad parasjagu ringlevate viirusevariantidega nakatumise ja tõsise haigestumise tõenäosust, neid on õiges kohas piisavas koguses, valdav osa elanikkonnast usaldab nende väljatöötamise ja kasutuselelubamise protsessi ning laseb end vaktsineerida. Aga ka siis ei pruugi lootus „normaalse elu taastumisele“ täituda, kuna lisaks bioloogilisele probleemile on pandeemia ka sotsioloogiline fenomen (Shah 2021).
Pärast vaktsiinide kasutuselevõtmist on paljudes riikides mõõdetud nende tõhusust tavatingimustes, väljaspool juhuslikustatud inimuuringuid.
Edinburghi Ülikooli teadlased olid esimesed, kes avaldasid 5,4 miljoni elaniku andmetele tugineva prospektiivse kohortuuringu, milles hindasid Pfizeri mRNA ja AstraZeneca adenoviirusvaktsiini ühe annuse mõju COVID-19 tõttu hospitaliseerimisele alates 28ndast vaktsineerimisjärgsest päevast. Haiglaravi vajadus vähenes mRNA vaktsiini toimel 85 protsenti ja adenoviirusvaktsiini mõjul 94 protsenti. Erinevalt varasematest inimuuringutest hinnati siin ka vaktsiini toimet üle 80aastastel ja leiti see noorematega samaväärne olevat (haiglaravi vajadus vähenes 81%) (Vasileiou et al. 2021).
Teine vaatlusuuring hindas Šotimaa tervishoiutöötajate vaktsineerimise mõju nende pereliikmete riskile nakatuda SARS-CoV-2 viirusega. Pärast tervishoiutöötaja vaktsineerimist Pfizeri mRNA- või AstraZeneca adenoviirusvaktsiini ühe annusega vähenes pereliikmete tõenäosus nakatuda 30 protsenti ja pärast tervishoiutöötaja vaktsineerimist kahe vaktsiiniannusega vähenes pereliikmete risk 54 protsenti (Shah et al. 2021).
Iisraeli ja Ameerika Ühendriikide teadlaste tehtud sobitatud kohortuuring, mis põhines Iisraeli massvaktsineerimise esimeste kuude andmetel ja kuhu kaasati 1,2 miljoni inimese andmed, mõõtis Pfizeri mRNA vaktsiini mõju 14 päeva pärast esimest ning alates 7ndast päevast pärast teist annust. Nakatumine vähenes vastavalt 46 ja 92 protsenti, sümptomaatilise COVID-19 haiguse esinemine 57 ja 94 protsenti, haiglaravi vajadus 74 ja 87 protsenti ning raske COVID-19 haigestumise esinemine 74 ja 87 protsenti (Dagan et al. 2021).
Ühendriikide haiguste kontrolli ja ennetuse keskuse kohortuuring, mis tehti 2021. aasta alguses kuue osariigi 3950 eesliinitöötajal, näitas, et SARS-CoV-2 nakkuse tõenäosus vähenes kaks nädalat pärast esimest mRNA vaktsiini annust 80 protsenti ja kaks nädalat pärast teist annust 90 protsenti (Thompson et al. 2021).
Neile andmetele tuginev optimistlik prognoos näeb vaktsineerimise, sesoonsuse ja loomulikul teel tekkiva immuunsuse koosmõjus COVID-19 tõttu hospitaliseerimise ja surmade olulist vähenemist juba eeloleval suvel. Teised mudelid arvestavad, et elanikkonna piisava osa immuunsus on visa tekkima, kuna kõiki (nt lapsi) ei saa praegu vaktsineerida, isegi kui vaktsiinide kättesaadavus paraneb, ning kuni veerand täiskasvanutest ei ole vaktsineerimisega nõus. Vaktsiinid ei taga täielikku kaitset nakatumise eest ja on vähem tõhusad mõnede uute viirusevariantide suhtes. Lisaks, loomulikul teel tekkiv immuunsus sõltub haigestumuse sesoonsusest ja inimestevaheliste kontaktide tihedusest. Seetõttu on ühe realistliku stsenaariumina mõistlik ette näha, et COVID-19 jääb püsima kui korduv hooajaline haigus (Murray, Piot 2021).
On koostatud mudeleid, mis näevad ette, et 2021/2022 talvel on võimalik COVID-19 haigestumuse tõus, nii uute variantide levides kui ilma (Saad-Roy et al. 2020). Kuna vaktsiinid näivad tõhusalt vähendavat raske COVID-19 haiguse esinemist vähemalt kõigi seniste variantide puhul, võib loota, et haiglate tööd halvavat ülekoormust ja liigsuremust saab vältida – kui me suudame olulise osa elanikkonnast vaktsineerida ja kui elanikel on jaksu taas järgida peamisi mittefarmakoloogilisi ennetusmeetmeid.
Kui näha COVID-19 sesoonset esinemist lähiaastatel reaalse võimalusena, saab suve pakutavat hingetõmbeaega kasutada eesmärgipäraselt, luues struktuuri kordusvaktsineerimisteks, tugevdades tervishoiusüsteemi valmisolekut ja kavandades riskirühmade ohutut toimetulekut soodustavaid tugimeetmeid. See tagab tõsiste piirangute väiksema riski, kui pessimistlikum prognoos peaks täituma, ent kõik need meetmed toovad ühiskonnas kasu ka juhul, kui õigus on optimistidel ja COVID-19 naaseb vaid harva puhanguna.
KOKKUVÕTE
COVID-19 vaktsiinide kasutuseletoomine 12 kuuga näitas, milleks tänapäeva terviseteadus ja -ettevõtlus on tugeva riikliku toe najal võimelised. See on ühelt poolt julgustav näide ka teiste tõsiste ja seni tõhusa ravita tõbede jaoks, aga dünaamilise ja paindliku arenduskeskkonna loomiseks oli vaja üleilmse kaose eelaimdust, mis suure tervisemõjuga, ent ühiskonna igapäevaelu ja kaaskodanike heaolu vähem mõjutavate haiguste puhul puudub.
Optimistlik prognoos näeb COVID-19 tõttu hospitaliseerimise ja surmade olulist vähenemist juba eeloleval suvel.
COVID-19 vaktsiinide arenduse kiirendamisel ei loobutud ajakohastest kvaliteedi- ja teadusstandarditest. Lühikese ajaga loodi vaktsiinide kvaliteetse masstootmise võimalused, millega ei ole kaasnenud tavalisest arvukamaid kvaliteediprobleeme, ning viidi läbi inimuuringud, mis olid suuremad, kui ühegi senise vaktsiini kasutusele lubamise eel tehtud.
Hoolimata ravimiarenduses tavaks olevast palju avatumast kommunikatsioonist ei õnnestunud arendajatel ega järelevalvajatel üldsusele ja meediale lõpuni selgitada COVID-19 vaktsiinide kasutusele lubamisele eelnenud uuringute põhjalikkust ega, teisalt, uute ravimite uuringute vältimatuid puudusi üliharvade kõrvaltoimete kirjeldamisel.
Kuna vaktsiinide ootuspärase toime ja kasu väljenduseks on haiguse puudumise üsna raskesti märgatav ja kirjeldatav fenomen, siis on avalik tähelepanu koondunud hea ravimijärelevalvesüsteemiga demokraatlikes riikides avalikult teada antavate kõrvaltoimete teemalisele arutelule, mis võib soodustada kahtlusi vaktsineerimise suhtes. Eestis ei ole see elanikkonna suhtumist vaktsineerimisse oluliselt muutnud (Turu-uuringute AS 2021).
COVID-19 olemasolevad ja uued, ridamisi kasutusele võetavad vaktsiinid on peamine vahend pandeemia peatamiseks. Korduva vaktsineerimise vajadus tundub praegustel andmetel tõenäoline ja arvestades viiruse senist muutumist on eelis vaktsiinidel, mille tehnoloogia võimaldab kiiret kohandamist uutele viirusevariantidele vastavaks.
KASUTATUD ALLIKAD
- ALEANIZY, F. S., MOHMED, N., ALQAHTANI, F. Y. ET AL. (2017). Outbreak of Middle East Respiratory Syndrome Coronavirus in Saudi Arabia: A Retrospective Study. – BMC Infectious Diseases, 17(23). DOI: 10.1186/s12879-016-2137-3
- BELL, D., JENKINS, P., HALL, J. (2003). World Health Organization Global Conference on Severe Acute Respiratory Syndrome. – Emerging Infectious Diseases, 9(9), 1191–1192. DOI: 10.3201/eid0909.030559
- CINES, D. B, BUSSEL, J. B. (2021). SARS-CoV-2 Vaccine-Induced Immune Thrombotic Thrombocytopenia. – The New England Journal of Medicine, 16 April. DOI: 10.1056/NEJMe2106315
- DAGAN, N., BARDA, N., KEPTEN, E. ET AL. (2021). BNT162b2 mRNA COVID-19 Vaccine in a Nationwide Mass Vaccination Setting. – The New England Journal of Medicine, 384(15), 1412–1423. DOI: 10.1056/NEJMoa2101765
- EUROPEAN MEDICINES AGENCY (2021). COVID-19 Vaccines: Authorised. – https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/vaccines-covid-19/covid-19-vaccines-authorised
- MAXMEN A., TOLLEFSON, J. (2020). Two Decades of Pandemic War Games Failed to Account for Donald Trump. – Nature 584, 26–29. DOI: https://doi.org/10.1038/d41586-020-02277-6
- MOORE, J. P., OFFIT, P. A. (2021). SARS-CoV-2 Vaccines and the Growing Threat of Viral Variants. – JAMA Network, 325(9), 821–822. DOI: 10.1001/jama.2021.1114
- MURRAY, C. J. L., PIOT, P. (2021). The Potential Future of the COVID-19 Pandemic: Will SARS-CoV-2 Become a Recurrent Seasonal Infection? – JAMA Network 325(13), 1249–1250. DOI: 10.1001/jama.2021.2828
- PARDI, N., HOGAN, M., PORTER, F. ET AL. (2018). mRNA Vaccines – A New Era in Vaccinology. – Nature Reviews. Drug Discovery, 17, 261–279. DOI: 10.1038/nrd.2017.243
- RUBIN, R. (2021). COVID-19 Vaccines vs Variants – Determining How Much Immunity Is Enough. – JAMA 325(13), 1241–1243. DOI: 10.1001/jama.2021.3370
- SAAD-ROY, C. M., WAGNER, C. E., BAKER, R. E. ET AL. (2020). Immune Life History, Vaccination, and the Dynamics of SARS-CoV-2 Over the Next 5 Years. – Science 370(6518), 811-818. DOI: 10.1126/science.abd7343
- SHAH, A., GRIBBEN, C., BISHOP, J. ET AL. (2021). Effect of Vaccination on Transmission of COVID-19: An Observational Study in Healthcare Workers and Their Households. – medRxiv, March 21 (preprint)… DOI: 10.1101/2021.03.11.21253275
- SHAH, H. (2021). COVID-19 Recovery: Science isn’t Enough to Save Us. – Nature, 591, 503. DOI: 10.1038/d41586-021-00731-7
- SIMPSON, C. R., CHAKRABARTI, A., ROBINSON, D. ET AL. (2020). Navigating Facilitated Regulatory Pathways During A Disease X Pandemic. – NPJ Vaccines. 23(5), 101. DOI: 10.1038/s41541-020-00249-5
- ZHANG, C., MARUGGI, G., SHAN, H. ET AL. (2019). Advances in mRNA Vaccines for Infectious Diseases. – Frontiers in Immunology, 10, 594. DOI: 10.3389/fimmu.2019.00594
- THOMPSON, M. G., BURGESS, J. L., NALEWAY, A. L. ET AL. (2021). Interim Estimates of Vaccine Effectiveness of BNT162b2 and mRNA-1273 COVID-19 Vaccines in Preventing SARS-CoV-2 Infection Among Health Care Personnel, First Responders, and Other Essential and Frontline Workers – Eight U.S. Locations, December 2020 – March 2021. – Morbidity and Mortality Weekly Report, 70(13), 495–500. DOI: 10.15585/mmwr.mm7013e3external icon
- TURU-UURINGUTE AS. (2021). Juba 75 protsenti inimestest on valmis end vaktsineerima. – https://turu-uuringute.eu/juba-75-protsenti-inimesest-on-valmis-end-vaktsineerima/
- VASILEIOU, E., Simpson, Colin R., ROBERTSON, C. ET AL. (2021). Effectiveness of First Dose of COVID-19 Vaccines Against Hospital Admissions in Scotland: National Prospective Cohort Study of 5.4 Million People. – Social Science Research Network Electronic Journal. DOI: 10.2139/ssrn.3789264